氨NH3
1.別名·英文名
液氨;Ammonia、Liquid amlllorlia.
2.用途
氮肥、銨鹽、硝酸、尿素、丙烯腈、三聚氰酰胺、丙烯酰胺、氫氰酸、無機試劑、藥品、染料、酸性中和劑、橡膠氧化劑、金屬表面氮化、制冷劑、半導體用氣體、氧化、氮化膜、化學氣相淀積、標準氣、校正氣、在線儀表標準氣。
3.制法
氫和氮在高溫高壓時在催化劑的作用下合成而得氨。
4.理化性質
分子量: 17.031
熔點(101.325kPa): -77.7℃
沸點(101.325kPa): -33.4℃
液體密度(-73.15℃,8.666kPa): 729kg/m3
氣體密度(0℃,101.325kPa):0.7708kg/m3
相對密度(氣體,空氣=1.25℃,101.325kPa):0.597
比容(21.1℃,101.325kPa): 1.4109m3/kg
氣液容積比:(15℃,100kPa): 947 L/L
臨界溫度: 132.4℃
臨界壓力: 11277kPa
臨界密度: 235kg/m3
壓縮系數:
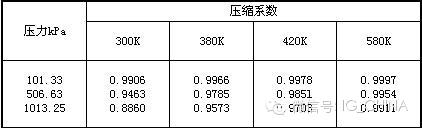
熔化熱(-77.74℃,6.677kPa): 331.59kJ/kg
氣化熱(-33.41℃,101.325kPa): 1371.18kJ/kg
比熱容(101.33kPa,300K): Cp=2159.97J/(kg·K)
比熱比(氣體,46.8℃,101.325kPa):CP/Cv=1.307
蒸氣壓(-20℃): 186.4kPa
(0℃): 410.4kPa
(20℃): 829,9kPa
粘度(氣體,20℃,101.325kPa):0.00982mPa·s
(液體,-33.5℃):0.255mPa·s
表面張力(20℃): 21.2mN/m
導熱系數(100kPa,300K):0.02470 W/(m·K)
(液體,10℃):0.501 w/(m·K)
折射率(氣體,0℃,101.325kPa): 1.000383
(氣體,25℃,101.325kPa): 1.0003442
空氣中可燃范圍(20℃,101.325kPa):15%~27%
空氣中最低自燃點(101.325kPa): 690℃
氧氣中可燃范圍(20℃,101.325kPa):14%~79%
氧氣中化學當量燃燒熱:17354 kJ/m3(高)
14361 kJ/m3(低)
毒性級別: 2(液氨:3級)
易燃性級別: 1
易爆性級別:0
火災危險: 中等度
氨在常溫常壓下為具有特殊刺激性惡臭的無色有毒氣體,比空氣輕。氨在常溫下穩定,但是在高溫分解成氫和氮。一般在一個大氣壓下450~500℃時分解,如果有鐵、鎳等催化劑存在,可在300℃時分解。
2NH3?3H2+N2
在空氣中可燃,但一般難以著火,如果連續接觸火源就燃燒,有時也能引起爆炸。如果有油脂或其它可燃性物質,則更容易著火。在氧中燃燒時發出黃色火焰,并生成氮和水。
氨在一氧化二氮中也能發生爆炸,爆炸濃度范圍為2.2%~72%。氨被氧、空氣和其它氧化劑氧化后生成氧化氮、硝酸等。與酸或鹵素發生激烈反應,并有時引起飛散或爆炸。
氨呈堿性,具有強腐蝕性,無水氨對大多數普通金屬不起作用,但是如果混有少量水分或濕氣,則不管氣態或液態都對銅、銀、錫、鋅及其合金發生激烈作用。又易與氧化銀或汞反應生成爆炸性化合物(雷酸鹽)。與鈉、鎂等金屬反應。
氨與水不反應,但易溶于水,并生成氫氧化銨,即氨水。氨水中氨的含量隨濃度和壓力而變化。氨水作為弱堿與酸反應。在1大氣壓下氨在水中的溶解度如下表所示。
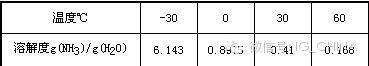
氨溶于甲醇、乙醇、二氯甲烷和乙醚。20℃時在酒精中的溶解度為14.8/100(酒精)。
液氨的蒸發潛熱僅次于水而很大,0℃時為301.8Cal/g。因此具有類似水的性質,好溶解許多物質。其溶液也顯示出許多與水溶液類似的性質。液氨能溶解胺鹽,各種金屬硝酸鹽、碘化物、酯類、酚類和胺類。
氨和一些物質混合接觸時的危險性如下表所示。
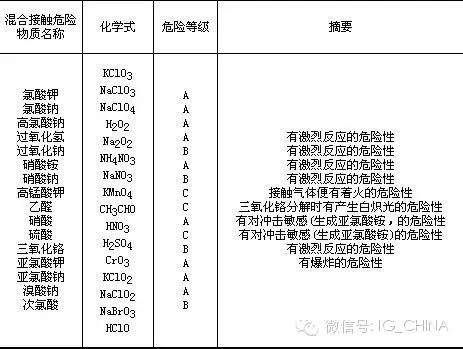
5.毒性
最高容許濃度:25ppm(18mg/m3)
不同濃度氨對人體的作用如下表所示。

氨主要通過呼吸道吸入,此外,也可以通過皮膚吸收。氨吸人體內后很快轉變成尿素。氨的毒害作用主要由下列三點引起:①減少三磷酸腺甙阻礙三羧酸循環,降低細胞色素氧化酶的作用;②腦氨增加,可引起神經方面的障礙;③高濃度氨的強烈刺激性引起組織的溶解和壞死。
吸入高濃度氨氣引起噴嚏、流涎、咳嗽、惡心、頭痛、出汗、臉面充血、胸部痛、呼吸急促、尿頻、眩暈、窒息感、不安感、胃痛、閉尿等癥狀。刺激眼睛引起流淚、眼疼、視覺障礙。皮膚接觸后引起皮膚刺激、皮膚發紅、可致灼傷和糜爛。
慢性中毒時出現頭痛、惡夢、食欲不振、易激動、慢性結膜炎、慢性支氣管炎、血痰、耳聾等。
吸入氨氣的患者應立即轉移到安全區安置休息并保暖。咳嗽時可服可待因。呼吸微弱或停止時立刻進行輸氧或人工呼吸。并速叫醫生來診治。
皮膚接觸時,立刻用水沖洗后再用肥皂水洗凈,然后蓋上用5%的醋酸、檸檬酸、酒石酸或鹽酸浸濕的敷料,也可以用2%以上的硼酸水濕敷。被液氨凍傷時,首先要適當解凍后脫下凍結的衣服。脫衣時要注意不要扯破皮膚,特別要注意清洗腋窩及會陰等潮濕部位(見附錄)。
眼睛受傷時,先用水清洗,或用0.5%~1%明礬溶液洗滌,然后滴入凡士林油或橄欖油。劇烈疼痛時,可滴人大約1~2滴1%的奴佛卡因或滴入I滴0.5%的地卡因腎上腺素(1:1000)溶液。
6.安全防護
接觸低濃度氨時,要戴氨用防毒口罩,接觸高濃度氨時要用供氣面罩。處理水溶液時,要穿高腰膠鞋、防護眼鏡、膠手套等。鋼瓶要存放在室外陰涼干燥通風良好之處,避免陽光直射,避免一切可能的撞擊。如在室內存放,一定要保證通風良好,要遠離熱源和火源,要與其它化學藥品,特別是與氧化性氣體、鹵素及酸類隔離,設備管道要嚴格密封,可用肥皂水、浸過鹽酸的布(遇氨生成氯化銨白煙)或靠其臭味探漏。
氨在室溫或高溫,水解或不水解,都腐蝕一些金屬材料,所以有必要選擇適當的材料。在干燥的氨氣中,可以使用奧氐體不銹鋼、鐵硅合金、銅和鋅合金、鎂合金、鎳、蒙乃爾、耐蝕鎳基合金、銀和銀合金、鉭。但是在潮濕的氨氣中不能用銅和銅鋅合金、鎳、蒙乃爾、銀和銀合金,可以用碳鋼。可以使用聚四氟乙烯、聚三氟氯化乙烯聚合體、聚乙烯、天然橡膠、丁睛橡膠、氯丁橡膠、海帕倫、丁基橡膠、硅橡膠和氟化橡膠。
著火時首先要關閉鋼瓶閥門,止住氣體流出。滅火可用霧狀水、二氧化碳、泡沫和干粉滅火劑。
當出現氨泄漏時,用濕草席等蓋在泄漏處或漏出來的氨液上,然后從遠處用水管沖洗。氣體大量噴出時,在遠處用噴射霧狀水吸收之。液體附著物要用大量水沖洗或用含鹽酸的水中和。
廢氣要用水吸收后鹽酸中和,再用水稀釋后排入下水道。也可用水吸收后用大量的水稀釋排入下水道。中和劑,除鹽酸外硫酸和其它酸也可以。
